Group 13 Boron –– 最近の論文から
◆三配位ホウ素化合物の安定化における新概念:平面固定トリアリールボラン
Planarized Triarylboranes: Stabilization by Structural Constraint and Their Plane-to-Bowl Conversion
Z. Zhou, A. Wakamiya, T. Kushida, S. Yamaguchi, J. Am. Chem. Soc., 134, 4529-4532 (2012).
[DOI: 10.1021/ja211944q]
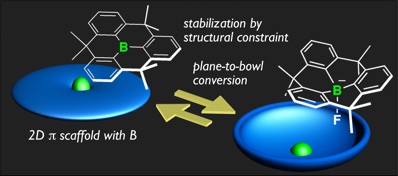
電子輸送性材料の開発は,有機エレクトロニクス分野の共通の重要課題の一つである.この点で,ホウ素をπ共役骨格に導入することは,電子受容性の富んだ電子構造を実現し,有用なアプローチである.問題となるのはその安定性であり,かさ高い置換基を導入してホウ素周りを立体的に保護するという手法がこれまで用いられてきた.しかし,この方法では,固体状態での分子間相互作用が重要な要素となる電子を流すという機能の発現には大きな障害となる.このジレンマに対し,今回、安定化の画期的な手法として,ホウ素を炭素骨格に組み込み「完全な平面構造に固定する」という設計コンセプトを提案した.モデルとなる平面固定トリフェニルボランの効率的な合成を達成し,実際に立体保護がなくとも十分に安定化できることを示した.また,このいわば“ホウ素ドーピング”により高い電子受容性のπ骨格の創製が可能であることを示した.今後,電子輸送性材料への応用が期待される.さらに,もう一つの重要な知見として,ホウ素を組み込んだ平面炭素骨格は,外部刺激に応答して構造変化を誘起できることも見いだした.フッ化物イオンなどのイオンと反応し,平面からボウル型構造へと変化する.この変化は可逆であり,負電荷をもつホスト材料として,新たなホストーゲスト科学への展開が期待される.
-
Related Papers:
-
1. T. Kushida, Z. Zhou, A. Wakamiya, S. Yamaguchi, Chem. Commun., 48, 10715-10717 (2012).
-
2. T. Kushida, S. Yamaguchi, Angew. Chem. Int. Ed., 52, 8054-8058 (2013).
-
3. T. Kushida, S. Yamaguchi, Organometallics, 32, 6654-6657 (2013).
-
4. A. Shuto, T. Kushida, T. Fukushima, H. Kaji, S. Yamaguchi, Org. Lett., 15, 6234-6237 (2013).
◆ホウ素ドープナノグラフェンの化学
Polycyclic π-Electron System with Boron at Its Center
S. Saito, K. Matsuo, S. Yamaguchi, J. Am. Chem. Soc., 134, 9130-9133 (2012).
[DOI: 10.1021/ja3036042]
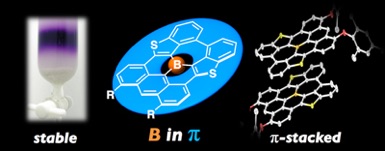
「ホウ素ドープグラフェン」は、半金属的なグラフェンとは異なり半導体特性を示したり、リチウムイオン電池の負極材料として高い電気容量と高速充放電に対する高いサイクル特性を示すことなどから、魅力的な特性をもつ材料として物理化学の分野で注目されている。しかしながら、物理学的な手法によって得ることができる「ホウ素ドープグラフェン」は、分子量も形状も揃っていないことから、科学的な電子状態の解明には至っていない。今回我々は、「ホウ素ドープグラフェン」のボトムアップ合成を意識し、形状のそろった単一化合物として、ホウ素を中央にもつ縮合多環式π共役分子「含ホウ素ナノグラフェン」 を開発し、その電子状態を詳細に解明することに成功した。今回合成した「含ホウ素グラフェン分子」は平面性が高く剛直であり、極めて安定な分子として扱うことができる。またこの分子は、電子供与性のπ平面の中央に電子受容性のホウ素を閉じ込めた効果により、高いHOMOレベルと低いLUMOレベルを実現している。これにより、可視領域全域を覆う吸収スペクトル、そして可視から近赤外領域に及ぶ蛍光スペクトルを示した。 今後、πスタック積層構造を実現することができれば、電子輸送材料としての応用に期待がもてる。
-
Related Papers:
-
1. C. Dou, S. Saito, K. Matsuo, I. Hisaki, S. Yamaguchi, Angew. Chem. Int. Ed., 51, 12206-12210
-
(2012).
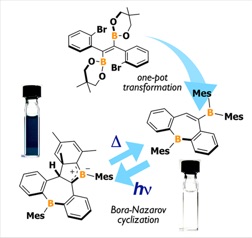
◆含ホウ素π電子系の新たな光反応:ホウ素版ナザロフ環化
Borylated Dibenzoborepin Synthesized via Skeletal Rearrangement and its Photochromism Based on Bora-Nazarov Cyclization
A. Iida, S. Saito, T. Sasamori, S. Yamaguchi, Angew. Chem. Int. Ed., 52, 3760-3764 (2013).
3配位ホウ素の一番の特徴は,カルボカチオンと等電子構造にあることである.カルボカチオンを含むπ電子系をホウ素で置換することにより,電荷が中性で,かつ単離可能なπ電子系をつくることができる.それに加えて,高い電子受容性に起因した特異な反応性も付与できる.その一つの例として我々は今回,9位にジメシチルボリル基をもつジベンゾボレピンを予期せず合成することに成功し,この化合物が顕著な吸収特性の変化を伴った光反応性を示すことを見出した.この反応は,Nazarov環化反応のホウ素版として理解できる.反応は,光照射により進行し,生成物は熱的に出発物に再変換されるという可逆性をもつ.生成物は,アリルカチオンの等電子構造であるボラタアリル骨格を含んでおり,狭いHOMO–LUMOギャップ等の特異な電子構造をもつことももう一つの特筆に値する特徴である.新たなフォトクロミック分子系として機能性材料への展開が期待できる.
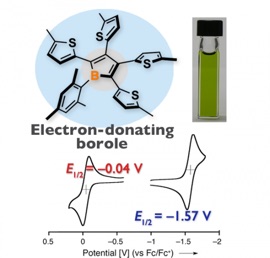
◆特異な電子構造をつくる:ボロールを含むπ電子系の化学
Electron-Donating Tetrathienyl-Substituted Borole
T. Araki, A. Fukazawa, S. Yamaguchi, Angew. Chem. Int. Ed., 51, 5484-5487 (2012).
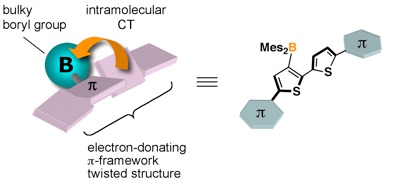
ホウ素を含む五員環共役ジエンであるボロールは,ホウ素の空のp軌道に起因して4π反芳香族性と高いルイス酸性をもつことから,その構造,反応性,および特異な物性という観点で近年注目を集めている.ボロールの最も重要な特徴の一つは極めて低い LUMO であり,高い電子受容性のπ共役骨格として広く認識されている.一方で今回我々は,ボロールが,シロールやホスホールなど他の電子受容性ヘテロール類と比較して高いHOMOをもつことに着目し,その特徴を引き出す新たな骨格としてチオフェン置換ボロールを新たに設計,合成した.テトラチエニルボロールは空気や水に対してきわめて不安定な緑色の化合物であり,ベンゼン置換ボロールと比較しても極めて狭い HOMO–LUMOギャップをもつことがわかった.さらに,電気化学測定の結果,テトラチエニルボロールがフェロセンに匹敵する低い酸化電位をもつことを示した.ホウ素化合物は電子受容性のみならず実は電子供与性にも富むことを明確に示した結果であり,ホウ素を含むπ電子系材料の分子設計に対して重要な知見を与えるものと期待される.
-
Related Papers:
-
1. C.-W. So, D. Watanabe, A. Wakamiya, and S. Yamaguchi, Organometallics, 27, 3496-3501 (2008).
-
[DOI: 10.1021/om8002812]
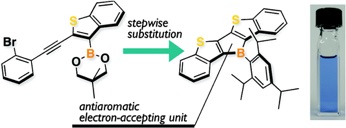
Thiophene-Fused Ladder Boroles with High Antiaromaticity
A. Iida, S. Yamaguchi, J. Am. Chem. Soc., 133, 6952-6955 (2011).
特異なボロール骨格を安定な材料として使うにはどうすればよいか.その一般的な方針は,立体的にかさ高い置換基をホウ素に導入し,速度論的に安定化し,かつ,ボロール環に芳香環を縮環させ,ボロールの反芳香族性を減少させることである.実際,これまでにホウ素にかさ高いアリール基をもついくつかの安定なジベンゾボロール誘導体が合成され,電子輸送性材料としての可能性や,アニオンセンサーへの応用が報告されている.しかし,縮環構造をもたせることにより安定化できるのは,芳香族性の高いベンゼンだけであり,ヘテロ環であるチオフェンやピロールを縮環させた場合には安定化には働かず,むしろ反芳香族性が増大し,より不安定になることが最近明らかになった.例えば,チオフェン縮環ボロールは何れも酸素,水に対して不安定であり,不活性雰囲気下で取り扱う必要があった.このことは,ホウ素上にTip基を導入したジベンゾボロール誘導体が空気中でシリカゲルカラムクロマトグラフィーにより精製できるのと対照的である.これはヘテロ環を縮環した場合には,ボロール環のブタジエン骨格における結合交替が小さくなり,ボロールの4π電子系としての反芳香族性が増大することに起因する.この高い反芳香族性を反映して,ヘテロ環縮環ボロールはベンゼン縮環ボロールや他のヘテロール類縁体とは大きく異なる物性を示す.例えば,チオフェン縮環ボロールのCH2Cl2中での吸収極大は600 nmであり,これは,ホウ素の代わりに他のヘテロ元素を導入しても全く実現できない値である.反芳香族性をもつユニークなπ電子系として位置づけられる.
-
Related Papers:
-
1. A. Iida, A. Sekioka, S. Yamaguchi, Chem. Sci., 3, 1461-1466 (2012).
-
[DOI: 10.1039/C2SC20100C]
-
2. A. Wakamiya, K. Mishima, K. Ekawa, S. Yamaguchi, Chem. Commun., 579-581 (2008).
-
[DOI: 10.1039/b716107g]
-
◆新奇な含ホウ素環状π電子系の創出:縮環ジボリンの化学
A B-B Bond-Containing Polycyclic π-Electron System: Dithieno-1,2-dihydro-1,2-diborin and Its Dianion
A. Wakamiya, K. Mori, T. Araki, and S. Yamaguchi, J. Am. Chem. Soc., 131, 10850-10851 (2009).
[DOI: 10.1021/ja905007s] (Highlighted in SYNFACTS)
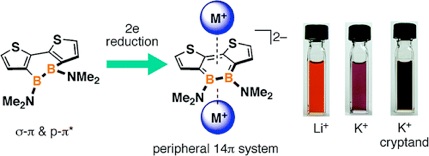
ホウ素を含む環状π共役骨格は,ホウ素の空の p 軌道を介した共役により特徴的な電子構造をもつ.その代表例が5員環ボロールであり,4π電子系に由来する反芳香族性をもつ.本研究では、ボロールのホウ素原子をホウ素ーホウ素結合で置き換えたジボリン骨格に着目し,この骨格を含むはじめての拡張π電子系の例として,ジチエノ縮環ジボリンの合成に成功した.そして,この骨格が特異な軌道相互作用により特徴的な光物性を示すこと,ジアニオン種が周辺共役による芳香族性を示すこと,また,ジアニオン種が対カチオンの種類に依存して大きく異なる吸収特性を示すことを明らかにした.
-
Related Papers:
-
1. T. Araki, A. Wakamiya, K. Mori, S. Yamaguchi, Chem. Asian J., 7, 1594-1603 (2012).
-
[DOI: 10.1002/asia.201200055]
◆高発光性有機固体の合理設計
3-Boryl-2,2'-Bithiophene as a Versatile Core Skeleton for Full-Color Highly Emissive Organic Solids
A. Wakamiya, K. Mori, S. Yamaguchi, Angew. Chem. Int. Ed., 46, 4273-4276 (2007).
[DOI: 10.1002/anie.200604935]
(Selected as a VIP and cover picture)

強い固体発光の実現は,有機エレクトロニクスなどの有機分子を題材とする機能化学において根本的な課題の一つである.本論文では,強い発光特性をもつπ電子系分子として,3位にボリル基をもつビチオフェンを設計し,これを鍵構造とする一連の誘導体が,溶液状態のみならず固体状態においても強い発光を示すことを明らかにした.導入する置換基の選択によりフルカラー発光の実現が可能である.さらに,この物性発現の理由について検討し,励起状態での構造制御の重要性を明らかにした.これらの結果は,発光性有機固体の設計に対して新たな指針を与える結果であり,Angewandte Chemie 誌の highlight として取り上げられた(G. C. Bazanら,Angew. Chem. Int. Ed., 47, 834-838 (2008)).
-
Related Papers:
-
1. C.-H. Zhao, A. Wakamiya, Y. Inukai, S. Yamaguchi, J. Am. Chem. Soc., 128, 15934-15935 (2006).
-
[DOI: 10.1021/ja0637550]
-
2. C. -H. Zhao, A. Wakamiya, S. Yamaguchi, Macromolecules, 40, 3898-3900 (2007).
-
[DOI: 10.1021/ma0702997]
◆ホウ素の配位数変化を生かした機能発現
Colorimetric Fluoride Anion Sensing by Boron-Containing pi-Electron Systems
S. Yamaguchi, S. Akiyama, K. Tamao, J. Am. Chem. Soc., 123, 11372 (2001).
[DOI: 10.1021/ja015957w]
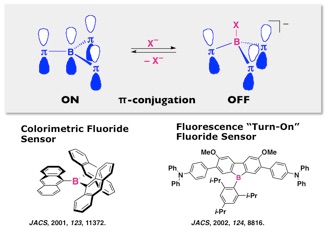
ホウ素を含むトリアリールボランπ電子系の一番の特長は,ホウ素の空のp軌道を介した共役の広がりであり,これにより特徴的な吸収・蛍光特性を示す.本論文では,これらのπ電子系が,ホウ素の高いルイス酸性によりフッ化物イオンを選択的に捕捉することが可能であり,その際の4配位ボラートの形成に伴い,前述の空のp軌道を介したπ共役が遮断され,光物性に大きな変化をもたらすことを,トリアントリルボランを用いて初めて示した.このことは,トリアリールボラン類がアニオンセンサーとして機能することを意味しており,後続の多くの化学センサー開発に対して,分子設計の礎を与えた.
-
Related Papers:
-
1. S. Yamaguchi, T. Shirasaka, S. Akiyama, K. Tamao, J. Am. Chem. Soc., 124, 8816 (2002).
-
[DOI: 10.1021/ja026689k]
-
2. S. Yamaguchi, T. Shirasaka, K. Tamao, Organometallics, 21(12), 2555 (2002).
-
[DOI: 10.1021/om020124f]
-
3. S. Yamaguchi, S. Akiyama, K. Tamao, J. Organomet. Chem., 652, 3 (2002).
-
4. S. Yamaguchi, S. Akiyama, K. Tamao, J. Organomet. Chem., 646, 277 (2002).
-
5. Y. Kubo, M. Yamamoto, M. Ikeda, M. Takeuchi, S. Shinkai, S. Yamaguchi, K. Tamao, Angew. Chem.
-
Int. Ed., 42, 2036-2040 (2003).
-
[DOI: 10.1002/anie.200250788]
Home | Topics | People | Research | Publications | Presentations | Photo | Links

Copyright (C) 2003-2013 Yamaguchi Group, Nagoya University.