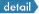アルキンの分子内環化を基盤とする縮環型 π 電子系の化学
-
Recent Review:
-
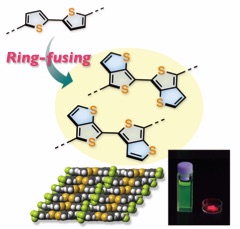
Ladder pi-Conjugated Materials Containing Main Group Elements
-
A. Fukazawa, S. Yamaguchi
-
Chem. Asian J., 4, 1386-1400 (2009). (Focus Review)
-
[DOI: 10.1002/asia.200900179]
Recent Topics –– 最近の論文から
◆ 近接したアルキン部位をもつ大環状デヒドロアヌレンの渡環環化
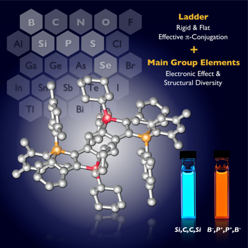
Thiophene-Fused Bisdehydro[12]annulene That Undergoes Transannular Alkyne Cycloaddition by Either Light or Heat
A. Fukazawa, H. Oshima, Y. Shiota, S. Takahashi, K. Yoshizawa, S. Yamaguchi, J. Am. Chem. Soc., 135, 1731-1734 (2013).
[DOI: 10.1021/ja3126849]
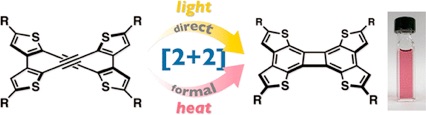
アルキンの分子内環化は,縮合多環式パイ共役骨格の構築法として強力な合成ツールである.中でも,アルキンの [2+2] 付加環化は,シクロブタジエン環を含むπ電子系の直截的な合成法であり,ありふれた教科書反応のようにみえるが,実は極めて例の少ない反応である.これまで報告されているアルキンの二量化によるシクロブタジエン誘導体の合成は,ほとんどが遷移金属を用いた形式的な [2+2] 付加環化であり,遷移金属を用いない場合には極端な加熱条件や活性化された基質を必要とする.これに対し本研究では,アルキンの [2+2] 付加環化を実現するための骨格として,チオフェン縮環ビスデヒドロ[12]アヌレンを設計,合成した.この化合物は,近接したアセチレン部位をもつ大環状π電子系であり,光照射によって [2+2] 付加環化が進行するのみならず,80ºC という温和な加熱条件においても同一の付加環化生成物を与えるというユニークな反応性をもつことを見いだした.理論計算によって,光反応が協奏的な [2+2] 付加環化であるのとは対照的に,熱反応は段階的な8πおよび4π電子環状反応を経た形式的な [2+2] 付加環化であることを解明した.さらに,この反応性において,縮環部位のチオフェンの適度に低い芳香族性が極めて重要な役割を果たしていることを明確に示した.得られた含シクロブタジエン縮環π電子系は,長波長領域での光吸収や高い電子受容性,多段階酸化還元特性を示すことから,新たなパイ共役系の基本骨格として,光電子機能性材料への応用が期待できる.
-
Related Papers:
-
1. A. Fukazawa, H. Oshima, S. Shimizu, N. Kobayashi, S. Yamaguchi, J. Am. Chem. Soc., Just Accepted Manuscript. [DOI: 10.1021/ja503499n]
-
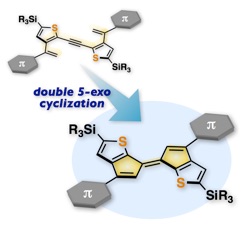
◆ 分子内二重 5-exo 環化によるチオフェン縮環オリゴアレーンの合成と固体構造制御
Diarylated Bi(thieno[2,3-c]thiophene)s: A Ring-Fusing Strategy for Controlling the Molecular Alignment of Oligoarenes
-
A.Fukazawa, D. Kishi, Y. Tanaka, S. Seki, S. Yamaguchi, Angew. Chem. Int. Ed., 52, 12091-12095 (2013).
π共役系分子はしばしば、希薄溶液と固体状態で大きく異なる性質を示す.固体状態での優れた光物性や半導体特性を実現するためには,どのような骨格を如何に配列させるかが極めて重要である.このような観点から我々は,一次元π電子系であるオリゴアレーンの背面にチオフェン縮環部位を導入するという分子設計を考案した.これらの効率的合成法としてジ(チオカルボニルアリール)アセチレン類の分子内二重環化反応を独自に開発し,連結位置の制御された種々のジアリールビ(チエノチオフェン)の合成を達成した.これらは縮環部位をもたないビチオフェンと比較して高い電子供与性や電気化学的安定性をもつことに加え,結晶状態で密なπスタッキング構造を形成し,顕著に異なる光物性を示す.このような固体構造に起因して,誘導体の一つは単結晶状態でペンタセン薄膜を凌駕する高い電荷移動度を示すことを明らかにした.
Photochemical Double 5-exo-dig Cyclization of Alkenyl-substituted Dithienylacetylenes: Efficient Synthesis of Diarylated Dithienofulvalenes
A. Fukazawa, T. Karasawa, H. Zhang, K. Minemura, C. Camacho, J. Wang, S. Irle, S. Yamaguchi, Angew. Chem. Int. Ed., 52, 10519-10523 (2013).
[DOI: 10.1002/anie.201303738]
◆ 分子内二重 5-endo 環化によるラダー型 π 電子系の合成と機能発現
Phosphonium and Borate-Bridged Zwitterionic Ladder Stilbene and Its Extended Analogues
-
A.Fukazawa, H. Yamada, S. Yamaguchi, Angew. Chem. Int. Ed., 47, 5582-5585 (2008).
[DOI: 10.1002/anie.200801834]
(Highlighted in SYNFACTS)
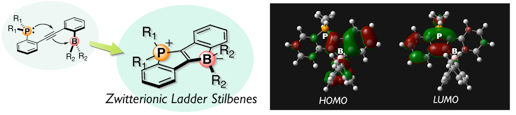
ラダー状に骨格を平面に固定したオリゴ(p-フェニレンビニレン)骨格を修飾して,最も特異な電子構造をもつπ電子系をいかにつくるか.本論文では,この問いに対する答えとして,ホスホニウムおよびボラートで架橋したラダー型オリゴ(p-フェニレンビニレン)類の合成と物性を報告している.ホスファニル基とボリル基をオルト位にもつジフェニルアセチレン類からの分子内求核的二重環化反応により,標的化合物を効率よく得ることに成功した.また,これらが双性イオン構造に起因して,高度に分極した電子構造をもち,長波長領域での吸収・蛍光などの特異な光物性を示すことを明らかにした.これらは新たな二光子吸収材料としての応用などが期待できる.
-
Related Papers:
-
1. A. Fukazawa, H. Yamada, Y. Sasaki, S. Akiyama, S. Yamaguchi, Chem. Asian J., 5, 466-469 (2010).[DOI: 10.1002/asia.200900517]
-
2. A. Fukazawa, E. Yamaguchi, E. Ito, H. Yamada, J. Wang, S. Irle, S. Yamaguchi, Organometallics, 30, 3870-3879 (2011). [DOI: 10.1021/om200453w]
Bis-Phosphoryl-Bridged Stilbenes Synthesized by an Intramolecular Cascade Cyclization
A. Fukazawa, M. Hara, T. Okamoto. E.-C. Son, C. Xu, K. Tamao, S. Yamaguchi, Org. Lett., 10, 913-916 (2008).
[DOI: 10.1021/ol7030608]
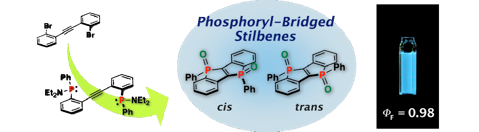
リンの最も重要な特徴の一つは非共有電子対の存在であり,これを足がかりとする多様な化学修飾,ひいては電子構造修飾が可能である.我々は特に,得られる化合物の電子構造の面白さと安定性の両面からホスフィンオキシド (P=O) に注目し,スチルベン骨格を2つのホスホリル基で架橋したビス(ホスホリル)架橋スチルベンの合成と物性を報告している.ビス(ホスファニルフェニル)アセチレン類の分子内ドミノ環化反応を見いだし,標的化合物を効率よく得ることに成功した.また,得られた化合物群がきわめて強い水色発光を示すことに加え,強い電子求引基であるホスホリル基の導入により高い電子受容性をもつことを示した.
-
Related Papers:
-
1. A. Fukazawa, Y. Ichihashi, Y. Kosaka, S. Yamaguchi, Chem. Asian J., 4, 1729-1740 (2009).
-
[DOI: 10.1002/asia.200900303]
-
2. A. Fukazawa, T. Murai, L. Li, Y. Chen, S. Yamaguchi, C. R. Chimie, 13, 1082-1090 (2010).
-
[DOI: 10.1016/j.crci.2010.04.021]
General Synthesis of Thiophene and Selenophene-Based Heteroacenes
T. Okamoto, K. Kudoh, A. Wakamiya, S. Yamaguchi, Org. Lett., 7, 5301-5304 (2005).
[DOI: 10.1021/ol0523650]
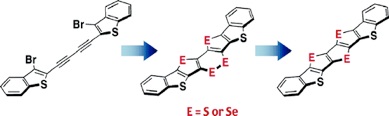
有機トランジスタ研究において,高い電荷移動度と高い化学安定性を併せもつ優れた有機半導体材料の開発が,発展の鍵を握る.本論文では,そのような潜在性をもつ化合物群として縮環オリゴチオフェン類に着目し,その効率的合成法の開発に取り組み,ジアセチレン類からの分子内三重環化反応を基軸とした方法論の開発に成功した.これによりチオフェン誘導体に加え,セレノフェン誘導体の合成も可能になった.また,得られた一連の誘導体のうち,ベンゾ縮環ペンタチエノアセン類は,実際に単結晶有機トランジスタの評価により,高い電荷移動度と高い安定性を兼ね備えた分子であることが明らかとなった(竹谷グループ(阪大)との共同研究. 下記論文3参照).実用化が十分に見込まれる化合物群である.
-
Related Papers:
-
1. K. Kudoh, T. Okamoto, S. Yamaguchi, Organometallics, 25, 2374-2377 (2006).
-
[DOI: 10.1021/om051000g]
-
2. T. Okamoto, K. Kudoh, A. Wakamiya, S. Yamaguchi, Chem. Eur. J., 13, 548-556 (2007).
-
[DOI: 10.1002/chem.200601064]
-
3. K. Yamada, T. Okamoto, K. Kudoh, A. Wakamiya, S. Yamaguchi, J. Takeya, Appl. Phys. Lett.,
-
90, 072102 (2007).
-
[DOI: 10.1063/1.2535617]
-
4. R. M. Osuna, R. P. Ortiz, T. Okamoto, Y. Suzuki, S. Yamaguchi, V. Hernandez, J. Teodomiro,
-
L. Navarrete, J. Phys. Chem. B, 111, 7488-7496 (2007).
-
[DOI: 10.1021/jp067262t]
-
5. Y. Suzuki, T. Okamoto, A. Wakamiya, S. Yamaguchi, Org. Lett., 10, 3393-3396 (2008).
-
[DOI: 10.1021/ol801136k]
-
6. H. Yoshida, Y. Watazu, N. Sato, T. Okamoto, S. Yamaguchi, Appl. Phys. A, 95, 185-191 (2009).
-
[DOI: 10.1007/s00339-008-5004-2]
-
7. R. M. Osuna, M. C. R. Delgado, V. V. Hernández, J. T. L. Navarrete, B. Vercelli, G. Zotti, J. J.
-
Novoa, Y. Suzuki, S. Yamaguchi, J. T. Henssler, A. J. Matzger, Chem. Eur. J., 15, 12346-12361
-
(2009).
-
[DOI: 10.1002/chem.200900246]
-
8. R. M. Osuna, V. Hernández, J. T. L. Navarrete, J. Aragó, P. M. Viruela, E. Ortí, Y. Suzuki,
-
S. Yamaguchi, J. T. Senssler, A. J. Matzger, ChemPhysChem., 10, 3069-3076 (2009).
-
[DOI: 10.1002/cphc.200900440]
-
9. J. Aragó, P. M. Viruela, E. Ortí, R. M. Osuna, B. Vercelli, G. Zotti, V. Hernández, J. T. L. Navarrete,
-
J. T. Henssler, A. J. Matzger, Y. Suzuki, S. Yamaguchi, Chem. Eur J., 16, 5481-5491 (2010).
-
[DOI: 10.1002/chem.200903343]
Home | Topics | People | Research | Publications | Presentations | Photo | Links

Copyright (C) 2003-2013 Yamaguchi Group, Nagoya University.