Dearomatization-Induced Transannular Cyclization: Synthesis of Electron-Accepting Thiophene-S,S-Dioxide-Fused Biphenylene
A. Fukazawa, H. Oshima, S. Shimizu, N. Kobayashi, S. Yamaguchi, J. Am. Chem. Soc., ASAP.
[DOI: 10.1021/ja503499n]
縮環部位の芳香族性によって反応性を制御する
2014/05/30

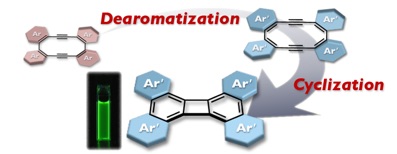
近接した複数のアルキンをもつデヒドロアヌレンは,渡環環化によって高度に縮環した拡張π電子系を与えることから魅力的な化合物群である.しかし,置換基をもたないデヒドロアヌレンは一般的に反応性が高く,合成自体が困難である.これらのデヒドロアヌレンを安定な化合物として合成するためには,芳香環を縮環させる方法が有力であるが,渡環環化の反応性自体も損なってしまう.これに対して我々は,芳香環が縮環したデヒドロアヌレンを出発原料として用い,縮環部位を「脱芳香族化」させるによって反応性を高めることを考えた.チオフェン縮環ビスデヒドロ[12]アヌレンのチオフェン上を酸化することで,室温においても渡環環化が進行することを見いだした.同じ化合物の加熱による環化が80 °C で9日を要するのとは対照的な結果であり,縮合多環式π電子系の実践的合成法として十分に期待できる.縮環部位の芳香族性のスイッチングにより,デヒドロアヌレンの安定性と反応性の制御が可能であることを示したといえる.
本法で得られたチオフェン-S,S-ジオキシド縮環型ビフェニレンは,剛直で広いπ平面をもつことに加え,電子求引性の SO2 部位の特徴を反映して高い電子受容性をもち,n型半導体の基本骨格としての潜在性が示唆された.また,SO2 の電子効果により他のビフェニレン誘導体とは異なる光学特性を示し,室温でも強い蛍光を示すことを見いだした.実践的な合成法との相乗効果により,機能性材料の新たな基本骨格としての展開が期待できる.
The transannular cyclization of dehydroannulenes bearing several alkyne moieties in close proximity is a powerful synthetic method of polycyclic aromatic hydrocarbons. We now report that the reactivity can be switched by the aromaticity of the ring skeletons fused with the dehydroannulene core. Thus, while thiophene-fused bisdehydro[12]annulene 1 can be handled as a stable compound in the air at room temperature, the oxidation with m-chloroperbenzoic acid (mCPBA) from the aromatic thiophene rings to the nonaromatic thiophene-S,S-dioxides induced the transannular cyclization even at room temperature, which was completed within 1 day to produce the formal [2+2] cycloadduct 3. This is in stark contrast to the fact that the thermal cyclization of 1 itself required heating at 80 °C for 9 days for completion. Experimental and theoretical studies indicated that the oxidation of even one thiophene ring in 1 sufficiently decreases the activation barrier for the transannular cyclization that proceeds through the 8π/4π electrocyclic reaction sequence. The thiophene-S,S-dioxide-fused biphenylene 3 thus produced exhibited a set of intriguing proper-ties, such as a higher electron affinity (E1/2 = –1.17 V vs Fc/Fc+) and stronger fluorescence (ΦF = 0.20) compared to the other relevant biphenylene derivatives, which have electron-donating and nonfluorescent characters.