Group 16 Sulfur –– 最近の論文から
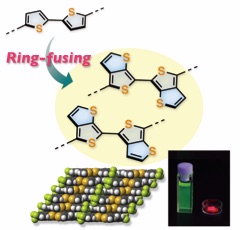
◆ チオフェン縮環によるオリゴアレーンの背面π拡張:固体構造制御のための新設計
Diarylated Bi(thieno[2,3-c]thiophene)s: A Ring-Fusing Strategy for Controlling the Molecular Alignment of Oligoarenes
-
A.Fukazawa, D. Kishi, Y. Tanaka, S. Seki, S. Yamaguchi, Angew. Chem. Int. Ed., 52, 12091-12095 (2013).
π共役系分子はしばしば、希薄溶液と固体状態で大きく異なる性質を示す。固体状態での優れた光物性や半導体特性を実現するためには、どのような骨格を如何に配列させるかが極めて重要である。このような観点から我々は、一次元π電子系であるオリゴアレーンの背面にチオフェン縮環部位を導入するという分子設計を考案した.これらの効率的合成法としてジ(チオカルボニルアリール)アセチレン類の分子内二重環化反応を独自に開発し、連結位置の制御された種々のジアリールビ(チエノチオフェン)の合成を達成した。これらは縮環部位をもたないビチオフェンと比較して高い電子供与性や電気化学的安定性をもつことに加え、結晶状態で密なπスタッキング構造を形成し、顕著に異なる光物性を示す。このような固体構造に起因して、誘導体の一つは単結晶状態でペンタセン薄膜を凌駕する高い電荷移動度を示すことを明らかにした。
◆ 新たな環化反応の開発を基盤とする縮環オリゴチオフェンの合成
General Synthesis of Thiophene and Selenophene-Based Heteroacenes
T. Okamoto, K. Kudoh, A. Wakamiya, S. Yamaguchi, Org. Lett., 7, 5301-5304 (2005).
[DOI: 10.1021/ol0523650]
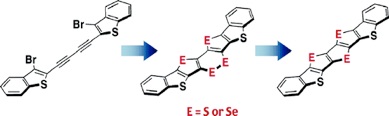
有機トランジスタ研究において,高い電荷移動度と高い化学安定性を併せもつ優れた有機半導体材料の開発が,発展の鍵を握る.本論文では,そのような潜在性をもつ化合物群として縮環オリゴチオフェン類に着目し,その効率的合成法の開発に取り組み,ジアセチレン類からの分子内三重環化反応を基軸とした方法論の開発に成功した.これによりチオフェン誘導体に加え,セレノフェン誘導体の合成も可能になった.また,得られた一連の誘導体のうち,ベンゾ縮環ペンタチエノアセン類は,実際に単結晶有機トランジスタの評価により,高い電荷移動度と高い安定性を兼ね備えた分子であることが明らかとなった(竹谷グループ(阪大)との共同研究. 下記論文3参照).実用化が十分に見込まれる化合物群である.
-
Related Papers:
-
1. K. Kudoh, T. Okamoto, S. Yamaguchi, Organometallics, 25, 2374-2377 (2006).
-
[DOI: 10.1021/om051000g]
-
2. T. Okamoto, K. Kudoh, A. Wakamiya, S. Yamaguchi, Chem. Eur. J., 13, 548-556 (2007).
-
[DOI: 10.1002/chem.200601064]
-
3. K. Yamada, T. Okamoto, K. Kudoh, A. Wakamiya, S. Yamaguchi, J. Takeya, Appl. Phys. Lett.,
-
90, 072102 (2007).
-
[DOI: 10.1063/1.2535617]
-
4. R. M. Osuna, R. P. Ortiz, T. Okamoto, Y. Suzuki, S. Yamaguchi, V. Hernandez, J. Teodomiro,
-
L. Navarrete, J. Phys. Chem. B, 111, 7488-7496 (2007).
-
[DOI: 10.1021/jp067262t]
-
5. Y. Suzuki, T. Okamoto, A. Wakamiya, S. Yamaguchi, Org. Lett., 10, 3393-3396 (2008).
-
[DOI: 10.1021/ol801136k]
-
6. H. Yoshida, Y. Watazu, N. Sato, T. Okamoto, S. Yamaguchi, Appl. Phys. A, 95, 185-191 (2009).
-
[DOI: 10.1007/s00339-008-5004-2]
-
7. R. M. Osuna, M. C. R. Delgado, V. V. Hernández, J. T. L. Navarrete, B. Vercelli, G. Zotti, J. J. Novoa,
-
Y. Suzuki, S. Yamaguchi, J. T. Henssler, A. J. Matzger, Chem. Eur. J., 15, 12346-12361 (2009).
-
[DOI: 10.1002/chem.200900246]
-
8. R. M. Osuna, V. Hernández, J. T. L. Navarrete, J. Aragó, P. M. Viruela, E. Ortí, Y. Suzuki,
-
S. Yamaguchi, J. T. Senssler, A. J. Matzger, ChemPhysChem., 10, 3069-3076 (2009).
-
[DOI: 10.1002/cphc.200900440]
-
9. J. Aragó, P. M. Viruela, E. Ortí, R. M. Osuna, B. Vercelli, G. Zotti, V. Hernández, J. T. L. Navarrete,
-
J. T. Henssler, A. J. Matzger, Y. Suzuki, S. Yamaguchi, Chem. Eur J., 16, 5481-5491 (2010).
-
[DOI: 10.1002/chem.200903343]
Home | Topics | People | Research | Publications | Presentations | Photo | Links

Copyright (C) 2003-2013 Yamaguchi Group, Nagoya University.